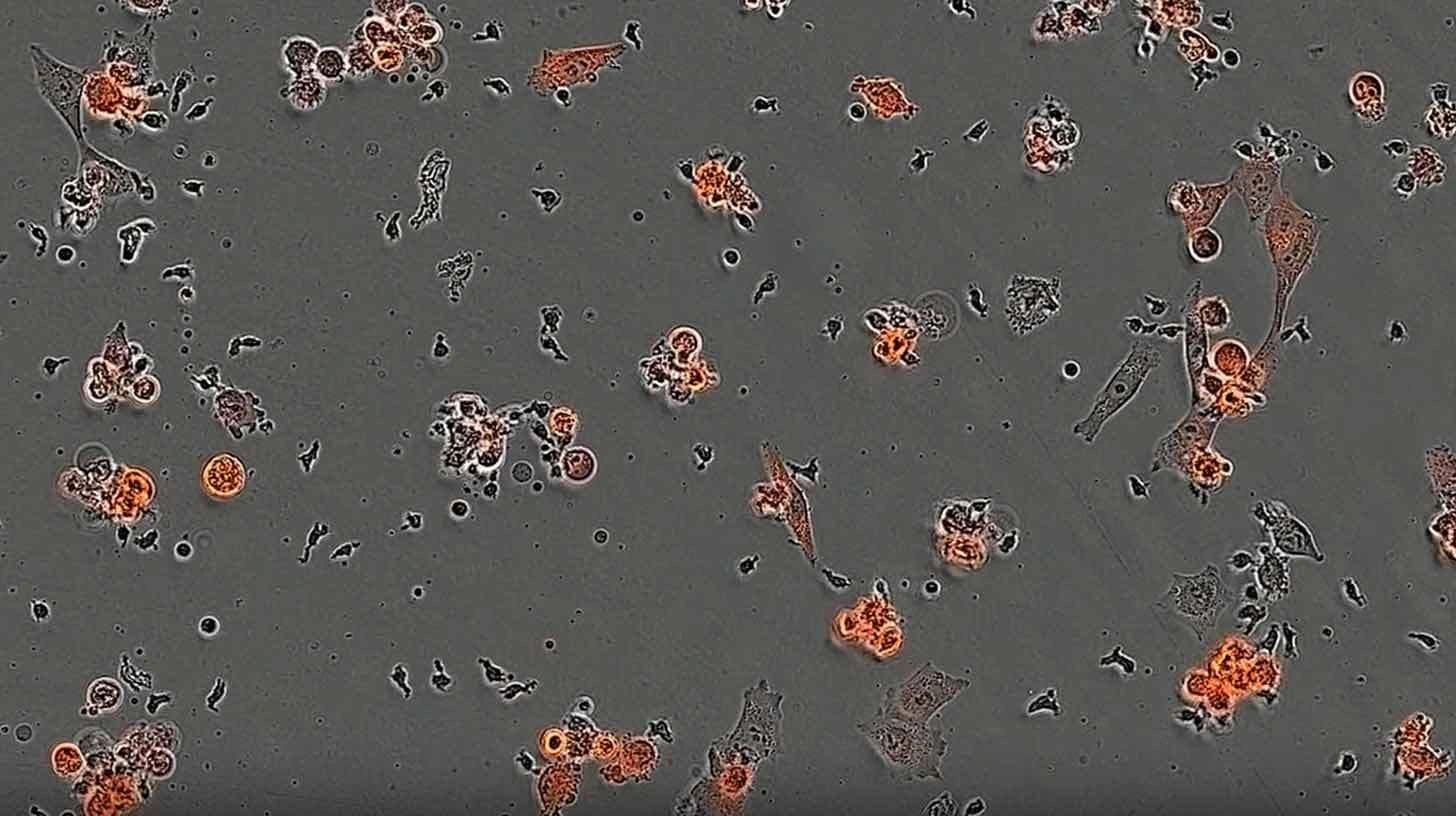
AI設計の「ミニバインダー」タンパク質がT細胞を導き、数週間でがんを破壊
デンマーク工科大学(DTU)の科学者チームはスクリプス研究所との共同で、 免疫細胞を精密な「がんキラー」へ変身させるカスタムタンパク質を設計する AI駆動プラットフォームを開発しました。この手法は、免疫療法開発の期間を 数年からわずか数週間へと劇的に短縮します。
🧬 ブレークスルー
このプラットフォームは、最先端の3つのAIモデルを活用し、 **「ミニバインダー」**と呼ばれる小型タンパク質を設計します。 これらはT細胞に取り付けられ、分子GPSユニットの役割を果たし、 特定の細胞表面マーカーに基づいてがん細胞を見つけ出し、攻撃するのを助けます。
プラットフォームの仕組みは以下の通りです:
- AIモデル1 が、がん関連タンパク質(抗原)の3D構造を解析します。
- AIモデル2 が、そのターゲットに結合可能な構造へ折りたたまれる アミノ酸配列を生成します。
- AIモデル3 が、数千の候補から有力なミニバインダーの ショートリストを作成します。
これらのミニバインダーはT細胞に取り付けられ、 特定のがんを標的とするエンジニアド免疫細胞―― IMPAC-T細胞(通称)を作り出します。
⚙️ 急速な設計、組み込みの安全性
このシステムは、Google DeepMindのノーベル賞受賞タンパク質構造予測ツール AlphaFold2を統合しており、各ミニバインダーの構造がどれほど 実現可能かを合成前に検証します。 設計から試験までの全工程は、従来の数年に対し、わずか4~6週間で完了します。
また、プラットフォームには仮想安全性スクリーニング工程も含まれており、 オフターゲット効果(正常組織への誤結合)のリスクを最小化します。 不適切なミニバインダー候補は実験室での試験前に排除されます。
🎯 汎用がんと個別がんの標的化
実験室テストでは、研究者たちは既知のがん抗原NY-ESO-1 (メラノーマ等の腫瘍で見られる)に対するミニバインダーを設計しました。 AI設計タンパク質はT細胞を正しく導き、ターゲット細胞の破壊に成功しました。
また、チームは患者固有のメラノーマ変異に対応するミニバインダーも 生成し、個別化免疫療法――患者ごとのがんマーカーに合わせた治療――の 可能性を示しました。
🧪 臨床応用までのタイムライン
初期結果は有望ですが、このプラットフォームは今後、 前臨床および臨床試験での検証が必要です。 研究者らは、5年以内にヒト治験が始まる可能性があると見積もっています。 最終的なゴールは、CAR-T療法のワークフローを模倣することです: 患者からT細胞を取り出し、AI設計ミニバインダーで改変して 再度体内へ戻し、腫瘍を探して破壊させます。
🌍 なぜ重要なのか
このイノベーションは単なるAIの話題ではなく、 本当の意味での個別化医療への転換点を示しています。 設計→試験サイクルを数年から数週間に短縮することで、 このようなAIプラットフォームは以下を実現し得ます:
- オンデマンドで個人の腫瘍プロファイルに基づいたがん治療を可能にする
- 医薬品開発スピードを劇的に高め、コストを削減する
- ウイルス、自己免疫疾患、希少遺伝病などにも応用可能な治療基盤となる
生成AI、タンパク質モデリング、合成生物学の収束によって AI駆動のバイオ医療の新時代が幕を開けつつあり、 DTUによるこの研究はその大きな一歩です。
出典: