AI-Designed “Minibinder” Proteins Guide T Cells to Destroy Cancer in Weeks
덴마크 공과대학교(DTU) 과학자 팀이 스크립스 연구소(Scripps Research)와 협력하여, 면역세포를 표적 암 세포 살상자로 설계하는 맞춤형 단백질을 설계하는 AI 기반 플랫폼을 개발했습니다. 이 접근법은 면역치료제 개발의 전체 기간을 기존의 수년에서 단 몇 주로 대폭 단축합니다.
🧬 혁신적인 돌파구
이 플랫폼은 최첨단 AI 모델 3가지를 결합하여 **“미니바인더(minibinder)”**로 불리는 소형 단백질을 설계합니다. 이 미니바인더는 T세포에 부착되어 분자 GPS 역할을 하며, 특정 세포 표면 마커를 토대로 암세포를 찾아 공격하도록 도와줍니다.
플랫폼의 작동 방식:
- AI 모델 1: 암 관련 단백질(항원)의 3차원 구조를 해석합니다.
- AI 모델 2: 표적에 결합할 수 있는 단백질로 접힐 수 있는 아미노산 서열을 생성합니다.
- AI 모델 3: 수천 개의 후보 중에서 효능이 높은 미니바인더를 선별해 최종 후보 리스트를 만듭니다.
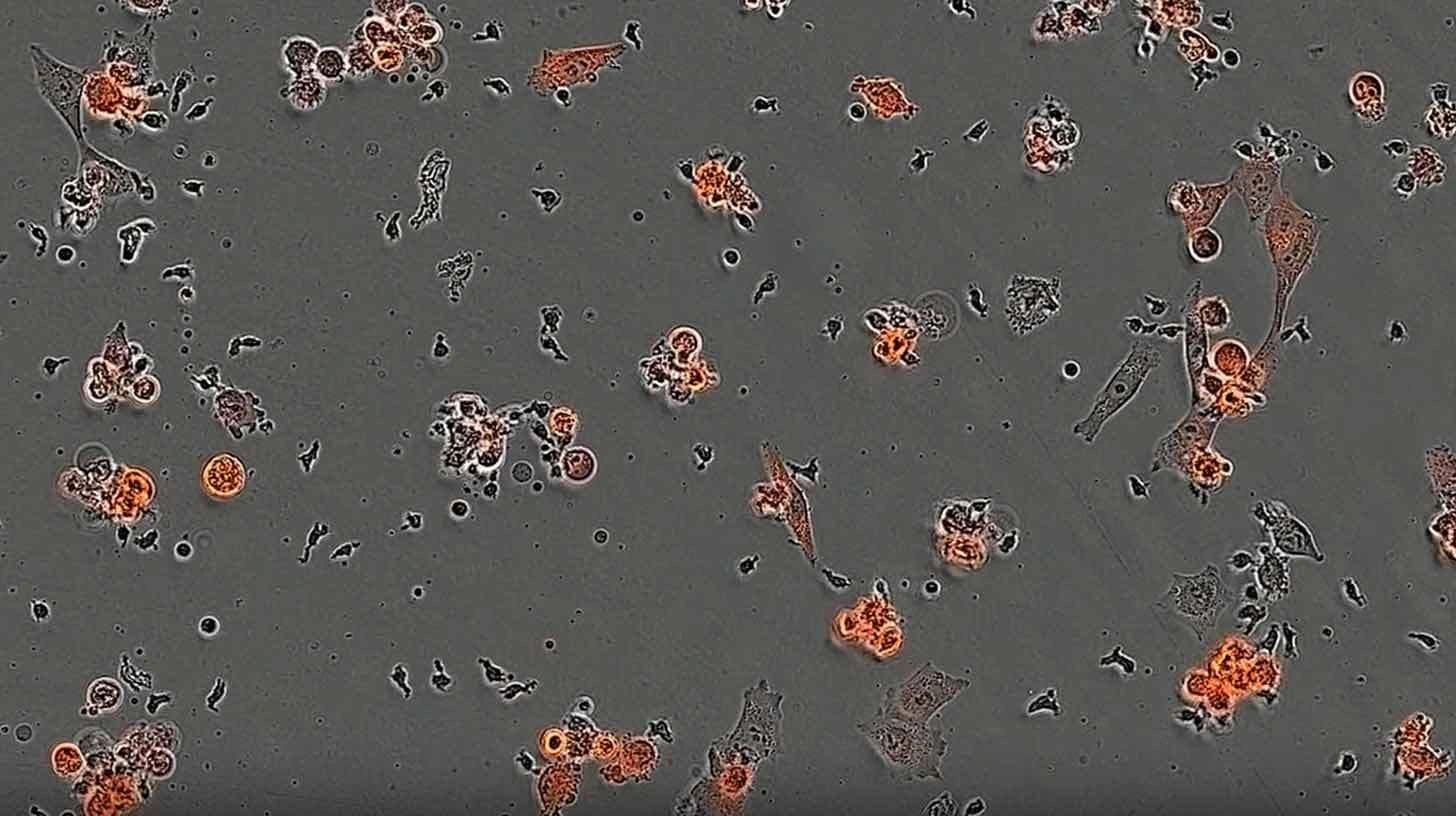
이렇게 선별된 미니바인더는 T세포에 부착돼, 특정 암을 사냥하도록 설계된 면역세포—IMPAC-T 세포라는 별명을 가진—로 재탄생합니다.
⚙️ 신속한 설계, 내장형 안전성
이 시스템은 Google DeepMind의 노벨상 수상 단백질 접힘 예측 도구인 AlphaFold2를 통합해, 합성 전 각 미니바인더의 구조를 검증합니다. 설계에서 실험까지 걸리는 전체 기간은 4~6주로, 기존의 수년에 비해 획기적으로 단축되었습니다.
비의도 표적 효과(Off-target effect) 리스크를 최소화하기 위해, 플랫폼에는 가상 안전성 스크리닝 절차도 포함되어 있습니다. 이 단계에서 미니바인더가 실수로 건강한 인체 조직에 결합할 위험을 예측·제거하여, 안전성 문제 후보를 실험 전에 걸러냅니다.
🎯 일반적 암·맞춤형 암 모두 타깃!
연구진은 실험실 테스트에서, 흑색종 및 기타 종양에 존재하는 암 항원인 NY-ESO-1 표적에 맞춘 미니바인더를 설계했습니다. AI가 만든 이 단백질은 T세포가 표적을 드러낸 세포를 성공적으로 파괴하도록 유도했습니다.
또한 연구팀은 환자별 흑색종 변이를 위한 미니바인더도 생성해, 개인 맞춤형 면역치료—환자 고유의 암 마커에 특화된—의 가능성도 시연했습니다.
🧪 임상으로의 로드맵
초기 결과는 유망하지만, 플랫폼은 아직 전임상 및 임상 검증을 거쳐야 합니다. 연구진은 실제 인간 대상 임상시험에 적용되기까지 약 5년이 걸릴 것으로 추정합니다. 궁극적으로는 CAR-T 치료와 유사한 프로세스를 목표로 하고 있습니다: 환자에게서 T세포를 추출하고, AI로 설계한 미니바인더로 수정 후, 다시 체내로 주입해 종양을 표적하게 한다는 것입니다.
🌍 왜 중요한가?
이 혁신은 단지 또 하나의 AI 뉴스가 아닙니다—진정한 개인 맞춤 의학으로의 전환을 상징합니다. 설계·테스트 주기를 수년에서 수주로 줄이면서, 이런 AI 플랫폼은 다음과 같은 혁신을 가능케 할 것입니다:
- 온디맨드 암 치료: 환자 개인의 종양 프로파일에 맞는 맞춤 치료 구현
- 신약 개발 속도 대폭 가속, 개발 비용 감소
- 바이러스, 자가면역질환 또는 희귀유전질병 등에도 유사 치료제 개발의 프레임워크 제공
생성형 AI, 단백질 모델링, 합성생물학이 융합되는 이 시대에, DTU의 이번 연구는 AI 기반 바이오의학의 새로운 장을 여는 중요한 발전입니다.
출처: